![]()
Solfonammide.
(o solfonamide).
Chimica
- Composto ammidico derivato da un acido solfonico, di formula generale RSO2NH2, ove R rappresenta un radicale alifatico o aromatico.
Tale composto si ottiene facendo reagire l'ammoniaca o, al suo posto, un'ammina primaria o secondaria, con un cloruro di solfonile.
Le s. sono acide, facilmente solubili nelle soluzioni acquose di idrossidi, e non si sciolgono nelle soluzioni acquose di bicarbonati perché più deboli degli acidi carbossilici.
Le s. alifatiche si presentano come solidi incolori, mentre quelle aromatiche sotto forma di cristalli incolori, poco solubili in acqua e solubili in soluzioni alcaline.
La sintesi delle s. viene sfruttata in chimica organica qualitativa come saggio per il riconoscimento delle ammine primarie e secondarie (saggio di Hinsberg): le s. delle ammine primarie si distinguono da quelle delle ammine secondarie per la loro diversa solubilità nella soda acquosa.
Esse vanno a costituire la classe di farmaci nota con il nome di sulfamidici.
![]()
![]()
Alifatico.
(dal greco áleiphar: unguento).
Chimica
- Di composto organico appartenente alla classe degli idrocarburi, che presenta una catena di atomi di carbonio aperta; per questo è anche detto idrocarburo aciclico, in contrapposizione a quelli detti ciclici o aromatici.
In questi composti gli atomi possono essere uniti fra loro da un legame semplice, e in questo caso, essendo le altre valenze unite ad atomi di idrogeno, l'idrocarburo a. viene definito saturo o paraffinico.
Sono composti assai stabili, con poca capacità di combinazione e di reazione con altri elementi.
Gli idrocarburi a. insaturi, invece, comprendono composti i cui atomi di carbonio sono uniti da un legame a doppia valenza (e in questo caso sono detti anche olefinici o etilenici o alcheni) o da un legame a tripla valenza (definiti come acetilenici o alchini).
║ Serie a.: comprende in generale tutte le sostanze costituite da catene aperte di atomi.
Poiché questa è una caratteristica propria anche degli acidi grassi, la serie è detta anche grassa.
║ Alcooli a.: derivano dagli idrocarburi appartenenti alla serie grassa.
A seconda del numero di ossidrili contenuti si dicono mono-, bi-, tri-valenti.
A seconda della posizione del gruppo ossidrilico si dividono in primari, secondari e terziari.
![]()
![]()
Aromàtico.
Che ha sapore e odore di aroma.
• Botanica
- Piante a.: piante appartenenti a diverse famiglie (principalmente Labiate, Rutacee, Conifere), capaci di elaborare sostanze dal profumo piacevole.
Sono utilizzate in medicina, erboristeria, profumeria e gastronomia.
Tra le più comuni usate in cucina citiamo la camomilla, l'anice, il finocchio, il bergamotto, i chiodi di garofano, le mente, la mirra, il genepì, l'assenzio, il caffè, la noce moscata; le principali adoperate in medicina sono il cloroformio, la cascarilla, la tintura di genziana.
Il maggior utilizzo delle piante a. si ha da parte delle industrie chimiche, che ne estraggono i principi a. (essenze).
• Chimica
- Composti a.: composti derivati del benzene.
Contengono nella loro molecola il nucleo esagonale nel quale le 6 valenze libere (delle 24 di cui i 6 atomi di carbonio dispongono) possono essere saturate da atomi o gruppi atomici uguali o diversi; la serie a. ha perciò un grande numero di derivati, di cui alcuni sono molto importanti dal punto di vista pratico.
Fra gli idrocarburi a. omologhi del benzene ricordiamo il toluene o toluolo e il dimetilbenzene o xilene.
![]()
Guadagnare navigando! Acquisti prodotti e servizi.
Guadagnare acquistando online.
![]()
Ammoniaca.
(dal greco ammoniakós: di Zeus Ammone, presso il cui tempio in Libia si erano raccolti per la prima volta i sali ammoniacali).
Chimica
- Composto di formula NH3.
È un gas incolore dal caratteristico odore, molto intenso, acre e irritante.
Estremamente solubile in acqua, tale caratteristica decresce significativamente con l'aumentare della temperatura.
Liquefa con facilità (a -33 °C) ed evaporando sviluppa un elevato calore.
Solidifica a -78 °C ed è più leggera dell'aria, con una densità relativa rispetto all'aria di 0,6 volte.
In soluzione acquosa, l'a. ha una reazione nettamente basica.
In atmosfera di ossigeno brucia, dando luogo alla formazione di azoto e di acqua, mentre forma solamente ossidi di azoto in presenza di catalizzatori.
In percentuali comprese tra il 16,5 e il 26,8%, forma miscele esplosive con l'aria.
L'a. viene conservata e trasportata allo stato puro e in forma liquida anidra sotto pressione (20 atmosfere) in bombole di acciaio da 10/15 kg.
Viene commercializzata anche in soluzione acquosa con una concentrazione che varia a seconda del tipo di utilizzo.
Le utilizzazioni dell'a. in campo industriale sono numerosissime.
Viene impiegata nell'industria dei fertilizzanti e degli esplosivi, in quanto forma i sali d'ammonio.
Nell'industria chimica, serve per la preparazione di urea, di nitrato, di solfato e fosfato d'ammonio, di acido nitrico.
Trova inoltre impiego negli impianti frigoriferi (per il suo elevato calore di evaporazione) e nella fabbricazione di moltissimi prodotti quali coloranti, materie plastiche, fibre sintetiche, ecc.
Usata anche nell'industria farmaceutica, la sua principale azione farmacologica è quella di stimolare le funzioni respiratorie.
L'a. si trova in natura in piccole quantità nelle esalazioni vulcaniche.
Essa costituisce anche uno dei normali prodotti della putrefazione di sostanze organiche azotate.
È inoltre presente nell'atmosfera del Sole e di alcune altre stelle.
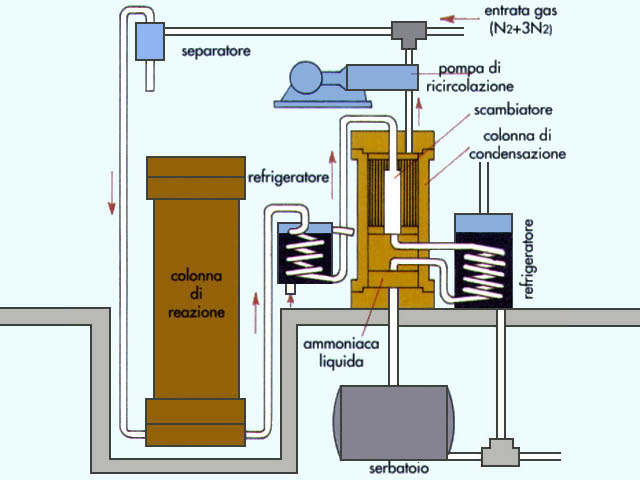
|| Produzione:
la preparazione industriale dell'a. si basa sulla reazione esotermica
di sintesi dagli elementi: N2 + 3H2
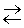 2NH3 favorita da basse temperature e da pressioni elevate.
2NH3 favorita da basse temperature e da pressioni elevate.
Questa sintesi fu realizzata su scala industriale nel 1913 ed è uno dei processi fondamentali dell'industria chimica.
Esso consiste nell'immettere nella colonna di reazione la miscela di azoto e idrogeno privo delle eventuali parti liquide, rimaste nel separatore.
La miscela passa quindi nei refrigeratori dove viene raffreddata; una parte di a. liquida evapora in questa fase, ma passa poi nel serbatoio che raccoglie i gas che non hanno reagito e che vengono ricircolati nello stesso reattore o inviati in reattori diversi posti in serie.
Schema del ciclo di produzione dell'ammoniaca per sintesi
• Biochimica
Presente in tutti gli organismi animali, l'a. deriva dai processi di trasformazione delle sostanze azotate (amminoacidi).
È libera in percentuali molto piccole, in quanto per la sua alta reattività forma altri composti.
Alcuni animali (ammoniotelici) la eliminano come tale; altri (ureotelici) la trasformano nel fegato in urea e la eliminano con le urine.
Ammina.
Chimica
- Composto organico azotato derivante dall'ammoniaca per sostituzione di uno, due o tre atomi di idrogeno con radicali alchilici, aliciclici, aromatici o eterociclici in pari numero. In riferimento al numero di atomi di idrogeno sostituiti, si possono avere le a. primarie, secondarie e terziarie. Il loro nome deriva dai radicali che si legano all'atomo di azoto, come per esempio metilammina o etilammina. Le a. più semplici, come l'anilina, si presentano sotto forma di gas o di liquido volatile, sono solubili in acqua, hanno odore simile a quello dell'ammoniaca, carattere basico, più o meno marcato a seconda dei radicali legati all'azoto. Al pari dell'ammoniaca, le a. sono capaci di addizionare gli acidi dando origine a composti a carattere salino (la metilammina addiziona l'acido cloridrico e si trasforma in cloruro di monometilammonio). Le a. primarie e secondarie danno molte reazioni simili a quelle dell'ammoniaca; questo avviene se esse reagiscono con i cloruri o le anidridi degli acidi, dando le ammidi corrispondenti. In presenza di acido nitroso le a. si comportano in modo diverso a seconda che esse siano primarie, secondarie o terziarie. Le primarie alifatiche danno alcoli, quelle aromatiche fenoli; le a. secondarie danno sempre nitrosammine; le terziarie alifatiche non reagiscono, quelle aromatiche danno i p-nitroso composti. Numerosi sono i metodi per ottenere le a.; a livello industriale in genere si preparano per alchilazione dell'ammoniaca con un alcool. Poiché le a. primarie reagiscono con alcool dando le a. secondarie e queste a loro volta reagiscono dando origine alle terziarie, per la loro separazione è necessario far ricorso alla distillazione. Sotto il profilo biochimico, le a. si trovano nell'organismo, in genere, come prodotti del ricambio intermedio delle sostanze proteiche (a. biogene).
![]()
![]()
Enciclopedia termini lemmi con iniziale a b c d e f g h i j k l m n o p q r s t u v w x y z
Storia Antica dizionario lemmi a b c d e f g h i j k l m n o p q r s t u v w x y z
Dizionario di Storia Moderna e Contemporanea a b c d e f g h i j k l m n o p q r s t u v w y z
Lemmi Storia Antica Lemmi Storia Moderna e Contemporanea
Dizionario Egizio Dizionario di storia antica e medievale Prima Seconda Terza Parte
Storia Antica e Medievale Storia Moderna e Contemporanea
Dizionario di matematica iniziale: a b c d e f g i k l m n o p q r s t u v z
Dizionario faunistico df1 df2 df3 df4 df5 df6 df7 df8 df9
Dizionario di botanica a b c d e f g h i l m n o p q r s t u v z
![]()