Manganese.
Elemento chimico di numero atomico 25, peso atomico 54,9380 e simbolo Mn. Nella tavola periodica degli elementi chimici si colloca nel gruppo VII, sottogruppo B, avendo come omologhi superiori il tecnezio e il renio. È l'elemento che nella serie dei numeri atomici precede immediatamente il ferro, pur appartenendo a un diverso gruppo; a sua volta esso è preceduto immediatamente dal cromo. Anche nel nostro organismo e nelle piante superiori, benché sia presente in quantità minima, svolge una funzione assai importante, in quanto entra a far parte di composti essenziali per la vita. Benché un suo minerale, la pirolusite, un ossido idrato, sia abbastanza comune e fosse noto da tempo, solo nel 1774 fu ritenuto l'ossido di un metallo fino ad allora sconosciuto (la scoperta è dovuta a C.W. Scheele). Nello stesso anno J.G. Gahn lo ottenne allo stato metallico per riduzione della pirolusite con carbone. ║ Stato naturale: il m. non è troppo abbondante nella crosta terrestre, della quale costituisce solo lo 0,085%; in piccole quantità tuttavia è diffuso in moltissime rocce e in quasi tutti i terreni. Nell'universo è relativamente più abbondante: si stima che ne esistano 6.850 atomi per ogni milione di atomi di silicio. Si ritiene poi che la massa che costituisce la parte centrale della Terra ne contenga circa il 2%. Nel corpo umano è presente solo in tracce dell'ordine di 0,3 ppm (parti in peso per milione): il sangue ne contiene circa 0,15 milligrammi per litro, ma i massimi tenori si registrano nello scheletro e nel pancreas. In natura il m. non esiste mai allo stato libero, se non in certe meteoriti ferrose. Il minerale più importante è la pirolusite, diffuso soprattutto in Germania, India, Brasile e USA. Normalmente esso contiene grandi quantità di ferro. Fra gli altri minerali, che non hanno quasi mai importanza pratica, ricordiamo la rodocrosite, un carbonato MnCO3, e la rodonite MnSiO3, un silicato della famiglia dei pirosseni, anch'esso alquanto raro. Esistono diversi minerali ossidati, e in particolare ossidi con diversa composizione (per impurezze) e anche diversa struttura cristallina. Una di queste, prodotta quasi esclusivamente da una miniera africana nella Costa d'oro, è particolarmente adatta per la fabbricazione di batterie a secco. ║ Preparazione industriale: si parte pressoché esclusivamente da biossido MnO2 purificato dalla ganga e a basso tenore di ferro. I principali metodi sono tre: 1) alluminotermia, 2) elettrolitico e 3) elettrolitico ad amalgama. Nel processo alluminotermico si prepara una miscela di MnO2 e alluminio metallico in polvere che viene poi incendiata per innescare la reazione di ossiriduzione seguente:
3MnO2 + 4Al ◊ 3Mn + 2Al2O3
che è fortemente esotermica. Il prodotto ottenuto è impuro per ferro, alluminio e diversi altri contaminanti presenti nel minerale, per cui ha un titolo del 98÷99%. Il processo elettrolitico, più costoso, fornisce però un metallo di purezza superiore. In questo caso il minerale viene trattato con un arrostimento per renderlo più solubile, poi viene portato a contatto con una soluzione ricca di acido solforico. In questa lisciviazione il m. passa in soluzione in forma di solfato manganoso. L'elettrolisi viene condotta in una cella che ha lo scomparto anodico separato da quello catodico da un diaframma. Nel primo scomparto, ove sono posti anodi insolubili di piombo, si forma nell'elettrolisi una soluzione acida che viene usata per attaccare il minerale. Nello scomparto catodico viene invece inviata la soluzione che proviene dalla lisciviazione del minerale. Il m. si deposita con una purezza del 99,9% su catodi di acciaio dai quali può essere facilmente staccato. Nel processo elettrolitico ad amalgama si opera una elettrolisi di una soluzione concentrata di cloruro manganoso; il catodo però è costituito da uno strato di mercurio sul quale si deposita m. che si trasforma in amalgama. Da questa, per distillazione, può essere facilmente recuperato. Assai semplice è invece la produzione della ferro-lega di m., che può essere impiegata direttamente nella metallurgia delle leghe ferrose (mentre per le leghe non ferrose occorre partire da metallo puro). In questo caso si parte da minerali ricchi in ferro o da una miscela di minerali di m. e di ferro. La riduzione può essere fatta al forno elettrico con carbone coke e calcare come scorificante, secondo una pratica normale di metallurgia. Per questo motivo il costo (per kg di m.) delle ferroleghe è basso. Talvolta per leghe speciali si deve limitare la quantità di carbonio presente nella ferrolega; il processo allora diventa assai più complesso e in certi casi può addirittura convenire l'impiego di m. puro (elettrolitico). Gran parte del m. viene però prodotta sotto forma di ferro-leghe, in quanto il maggior consumo si ha nella fabbricazione di leghe ferrose; per alcune di queste si può utilizzare direttamente il minerale di m., alimentandolo direttamente in altoforno. Il m. è un metallo destinato a diventare raro entro pochi anni, allorche si saranno esaurite le riserve facilmente sfruttabili, che ammontano a circa 725 milioni di tonnellate. Presupponendo che il tasso di aumento dei consumi resti quello attuale, cioè il 3% annuo circa, esso si esaurirà in meno di 50 anni. Sono stati però scoperti dei fondali marini sui quali si trovano grandi quantità di noduli ricchi di m.; se queste risorse divenissero sfruttabili il problema dell'esaurimento di questo metallo sarebbe rinviato di vari decenni. È da notare che il m., dato l'impiego che si fa, è riciclato come rottame solo in quantità minima. ║ Proprietà fisiche: il m. si presenta come un metallo duro, splendente, di color bianco argento. Presenta quattro forme allotropiche, stabili in campi diversi di temperatura. In condizioni ambiente si ha la forma α che per riscaldamento a 678 °C passa alla forma β che a sua volta a 1.100 °C si trasforma nella forma γ: questa passa poi a 1.138 °C a una forma δ che giunge a fusione a 1.245 °C. Il punto di ebollizione è invece 2.150 °C. Trascurando la forma δ. stabile solo alle temperature più elevate e della quale si sa poco, osserviamo che il m. anche puro può essere ottenuto a temperatura ambiente anche nella forma β metastabile, mentre la forma γ non si può ottenere, se non stabilizzandola mediante altri elementi anche se in piccoli tenori. Le tre forme α, β e γ hanno rispettivamente le seguenti strutture cristalline: cubica complessa con 58 atomi per cella, cubica complessa con 20 atomi per cella e tetragonale. A temperatura ambiente il peso specifico è 7,43 per la α, 7,29 per la β e 7,18 per la γ. Il metallo puro non può essere sottoposto a colata in quanto dapprima si forma la struttura γ ma poi si ha la formazione della fase α e, data la differenza di peso specifico, il metallo si contrae e si spezza in piccoli pezzi. È da osservare che mentre le fasi α e β sono fragili, la fase γ è duttile e malleabile, per cui tutte le leghe ad alto tenore di m. devono essere in grado di stabilizzare la fase γ. È interessante osservare che il metallo elettrodeposto si trova nella struttura γ che poi si tramuta in α (col noto comportamento); questa trasformazione può essere bloccata conservando il pezzo sotto gli 0 °C. Le reazioni di passaggio dalla fase α alle successive sono tutte endotermiche: la α ◊ β per 535 cal/g-atomo, la β ◊ γ per 545 e la γ ◊ δ per 430; il calore latente di fusione è 63,7 cal/g mentre quello di vaporizzazione è 53,7 kcal/g-atomo. Il m. presenta una massa conducibilità elettrica di volume, pari solo allo 0,9% dello IACS (campione internazionale di rame ricotto); la conducibilità termica non è nota con precisione. Per quanto riguarda le proprietà meccaniche, quelle delle prime due fasi, fragili, non sono interessanti; invece la fase γ presenta a temperatura ambiente i seguenti valori (estrapolati): carico di rottura a trazione 50 kg/mm², carico di snervamento 25 kg/mm², allungamento a rottura 40% e durezza scala Rockwell-C 35. Dal punto di vista delle proprietà magnetiche, il m. massiccio è amagnetico a qualsiasi temperatura; si possono però ottenere delle modificazioni strutturali (ad es. causate da gas disciolti e poi liberati) che lo rendono magnetico. Sono magnetici diversi suoi composti, fra i quali i boruri e nitruri, e diverse leghe non ferrose, ad es. con rame e alluminio. Il m. presenta in natura un solo isotopo stabile, il 55Mn che ha quindi abbondanza 100%. Fra i suoi isotopi sintetici ricordiamo i due principali, il 52Mn e il 54Mn; essi hanno un periodo (tempo nel quale una massa di un isotopo si decompone per metà per effetto del decadimento radioattivo) di 5,7 e 291 giorni rispettivamente. Il primo, introdotto nell'organismo umano, si ritrova poi in tutto l'organismo; per la sua elevata radioattività viene usato soprattutto per irraggiamenti locali, come ad es. delle ghiandole linfatiche. Il 55Mn invece è meno radioattivo e viene usato per lo più per studi sul metabolismo minerale dell'organismo. Entrambi sono poi impiegati per ricerche in botanica, dato che il m. sembra concentrarsi nella clorofilla. Il m. ha un raggio atomico di 1,26 Å (1 Å = 10 -10 metri), pari a quello del ferro, con cui ha notevole tendenza a formare leghe: il diagramma ferro-m., se non fosse complicato dalle varie forme allotropiche, mostrerebbe una solubilità completa sia allo stato liquido che solido. Anche l'elettronegatività secondo Pauling (1, 5) non è molto lontana da quella del ferro (1,8). È da ricordare ancora che mentre nelle valenze più basse il raggio ionico del m. è abbastanza elevato (0,80 Å per la +2) alle valenze più alte è molto piccolo (0,46 Å per la +7) come succede per gli elementi che non hanno spiccata tendenza a formare anioni. ║ Proprietà chimiche: il m. è dotato di buona stabilità all'aria perfettamente secca, ma in presenza di un minimo di umidità viene facilmente aggredito, denotando un comportamento simile al ferro, con maggior reattività. In stato di fine suddivisione è piroforico e decompone l'acqua bollente. Da un punto di vista puramente chimico, va quindi considerato non tanto un metallo quanto un semimetallo o addirittura un non-metallo. In effetti esso presenta tutte le valenze della + 1 alla + 7 (anche se nelle valenze 1,5 e 6 non si conoscono gli ossidi); mentre nella valenza +2 è decisamente metallo (l'ossido è decisamente basico), nelle valenze superiori, tipicamente la 6 e la 7, è decisamente acido, dando origine ad anioni ossidati molto stabili. I composti di m. bivalente, o m. (II) si dicono manganosi, quelli di Mn(IV) si dicono manganici mentre quelli con valenze superiori sono manganati o permanganati. ║ Principali composti: il comportamento del m. è molto diverso secondo lo stato di ossidazione, per cui anche i composti saranno trattati separatamente con questo criterio, trascurando altresì i meno importanti. A) Composti manganosi. Sono quelli in cui il m. manifesta la valenza +2; lo ione Mn²+, in assenza di altri ioni colorati, appare rosa chiaro in soluzione acquosa. L'ossido manganoso MnO esiste in natura come manganosite e si può ottenere dal carbonato MnCO3 per decomposizione fuori dal contatto con l'aria (altrimenti si formerebbe Mn3O4). Si presenta come un solido grigio-verde di peso specifico 5,18 che fonde a 1.650 °C ed è insolubile in acqua, ma si scioglie nella maggior parte degli acidi e in cloruro di ammonio in soluzione. All'aria si ossida spontaneamente a Mn3O4. L'idrossido manganoso Mn(OH)2 precipita bianco dalle soluzioni di Mn2+ basificate; all'aria imbrunisce ossidandosi all'idrato del biossido (MnO) 2 (OH) 2 di colore nero. Si trova in natura come pirocroite, un minerale estremamente raro. È pressoche insolubile in acqua calda, leggermente solubile in quella fredda; si scioglie negli acidi e nei sali di ammonio, ma non negli alcali. Per riscaldamento si decompone prima di fondere. Il solfato manganoso MnSO4 si può preparare anche anidro, ma comunemente viene commerciato come tetraidrato MNSO4 · 4H2O, è un solido rosa stabile a temperatura ambiente, molto solubile in acqua, che per riscaldamento perde l'acqua di cristallizzazione a 450 °C. Il sistema solfato manganoso-acqua è molto complesso: secondo le condizioni operative si può ottenere per precipitazione con un numero di molecole d'acqua variabile fra 1 e 7. Quello con 5H2O è isomorfo col solfato rameico, quello con 6H2O forma solfati doppi coi metalli alcalini (isomorfi coi colfati doppi del magnesio) mentre quello con 7H2O, detto vetriolo rosa, è isomorfo con solfato ferroso. Viene preparato in certi processi estrattivi per elettrolizzarlo. Il solfuro MnS esiste in natura come alabandite, molto raro, e si può precipitare anidro o idrato, coi solfuri alcalini; scaldato in aria si decompone, ma nel vuoto fonde a 1.620 °C. È insolubile in acqua, ma si scioglie negli acidi diluiti. Fra gli alogenuri di Mn(II), il fluoruro MnF2 poco solubile in acqua e fonde a 856 °C, il cloruro MnCl2 (esistente in natura come scacchite) fonde a 650 °C ed è solubilissimo in acqua; comunemente viene però impiegato come tetraidrato; il bromuro MnBr2 invece, sia anidro che tetraidrato, è solubilissimo in acqua, ma si decompone per riscaldamento a temperatura moderata. Il carbonato manganoso MnCO3 esiste in natura come rodocrosite, isomoda con la calcite e la siderite. È poco solubile in acqua, ma si scioglie negli acidi diluiti e in una soluzione di CO2 dando un bicarbonato; per riscaldamento si decompone come già detto. Il cianuro manganoso Mn(CN)2 presenta la caratteristica di formare facilmente sali complessi come i manganocianuri del tipo K4Mn(Cn)6 analoghi ai ferrocianuri. Infine merita di essere ricordato l'ossido salino Mn3O4 che è da considerare come manganito manganoso 2MnO · MnO2 per cui viene anche detto ossido manganoso-manganico. È una polvere nero-bruna di peso specifico 4,718 che fonde a 1.705 °C, è insolubile in acqua, ma si scioglie in acido cloridrico o solforico. B) Composti manganici. Allo stato trivalente il m. ha un comportamento debolmente basico, ma può facilmente essere anfotero. L'ossido manganico Mn2O3 non è che un ossido salino MnO · MnO2; si presenta come un solido bruno-nero, di peso specifico 4,81, insolubile in acqua, ma solubile negli acidi; per riscaldamento perde ossigeno a 1.800 °C. L'idrossido manganico Mn(OH)2 ovvero MnO2 · H2O esiste in natura come manganite; è bruno, insolubile in acqua, ma solubile in acido solforico concentrato; per riscaldamento si decompone. I composti di Mn(III) presentano in generale le tendenze a dismutare in soluzione, dando composti di Mn(II) e permanganati. Nella valenza +4, abbastanza stabile, il Mn ha un comportamento decisamente acido; così l'idrato Mn(OH)4 è da considerare un acido H4MnO4 tanto è vero che con basi forti può dare dei manganiti. Il composto più importante del Mn(IV) è il biossido MnO2, esistente in natura come minerale in diverse forme (pirolusite, polianite, psilomelano) e detto talvolta, ma impropriamente, anche perossido di m. È una polvere a struttura rombica (o tetragonale) di peso specifico 5,026 che per riscaldamento perde ossigeno sopra i 230 °C. È insolubile in acqua fredda e calda e in acido nitrico; si scioglie invece abbastanza bene in acido cloridrico. Si può preparare molto puro per decomposizione termica del nitrato Mn(NO3)2 a circa 200 °C oppure per reazione fra carbonato manganoso MnCO3 e clorato potassico KclO3 a circa 300 °C. La sua forma idrata MnOH2O ha carattere acido, anche se non troppo spiccato. Esso in soluzione acida si comporta da energico ossidante, dato che il m. passa a Mn(II); ad es. in presenza di acido cloridrico si ha:
MnO2 + 4HCl ◊ Cl2 + MnCl2 + 2H2O
cioè l'ossidazione di parte del cloro. Per questo motivo viene impiegato come agente depolarizzante nelle pile a secco, in chimica organica e nella fabbricazione dei vetri: in questo caso viene anche detto sapone dei vetrai, in quanto esso fa scomparire la tipica colorazione verde che le impurezze di ferro tendono a impartire al vetro. I sali di Mn (IV) come catione sono poco stabili; ricordiamo fra questi il solfuro MnS2, esistente anche in natura come hauerite, il percloruro MnCl4, che dà facilmente sali doppi con cloruro alcalini, e il solfato Mn(SO4)4, facilmente ossidabile e idrolizzabile. C) Ipomanganati. Detti anche pentamanganati, sono i sali di Mn(V); sono poco stabili e non hanno praticamente alcuna applicazione pratica. D) Manganati e ipermanganati. Sono così detti rispettivamente i composti di Mn(VI) e Mn(VII), tutti spiccatamente acidi. Per fusione di un composto di m. con nitrato o clorato potassico, oppure con KOH in presenza di un ossidante, si ha la formazione di un composto che, sciolto e cristallizzato, ha formula K2MnO4, detto manganato potassico, ed è isomorfo con corrispondente cromato e solfato. Si presenta come una polvere verde cristallina che si decompone per riscaldamento a 190 °C oppure per contatto con acqua fredda, solubile in KOH. L'acqua in realtà lo fa dismutare secondo la reazione:
3K2MnO4 + 2H2O ◊ MnO2 + 4KOH + 2KMnO4
con formazione del permanganato potassico KMnO4 assai più stabile, che colora intensamente in violetto la soluzione. La trasformazione non è quantitativa, ma lo può diventare se nella soluzione si passa un ossidante come ozono o cloro; avviene allora una reazione del tipo:
K2MnO4 + Cl2 ◊ 2KMnO4 + 2KCl
Il permanganato potassico si presenta in cristalli rosso porpora, con riflessi violetti, cristallizzato nel sistema rombico e isomodo con il perclorato potassico KClO4. In acqua si scioglie meglio a caldo che a freddo (un litro ne scioglie 28,3 grammi a 0 °C e 323,5 grammi a 75 °C); la soluzione è colorata intensamente in violetto anche con piccolissime quantità di sostanza. Per riscaldamento si decompone sopra i 240 °C liberando ossigeno. È però un fortissimo ossidante anche in soluzione acquosa, dato che in ambiente acido si riduce a sale di Mn(II) per cui due molecole di permanganato possono cedere ben 5 atomi di ossigeno. Ad es. da una soluzione di acido solfidrico H2S viene liberato zolfo elementare secondo la reazione (che per semplicità viene scritta in forma ionica):
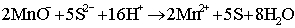
Se l'ossidazione è tale da consumare tutto il permanganato presente, la colorazione passa dal violetto (colore dello ione) al rosa pallido (colore dello ione Mn2+) per cui questo fatto può essere sfruttato per titolazioni analitiche (ossidimetria senza bisogno di indicatore). Il comportamento ossidante dipendente anche dal pH della soluzione; mentre in ambiente acido si ha il comportamento ora visto, in ambiente neutro o debolmente basico esso passa da valenza 7 a valenza 4, secondo una reazione del tipo:
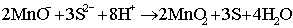
In ambiente fortemente basico, si ha invece la riduzione del Mn(VII) a Mn(VI) con formazione del manganato K2MnO4. Per queste sue proprietà ossidanti, il permanganato potassico è ampiamente utilizzato in laboratorio chimico e nell'industria chimica soprattutto organica; ha anche proprietà antisettiche e le sue soluzioni sono talvolta usate a questo scopo, ma ha lo svantaggio di macchiare in violetto gli indumenti. In modo simile si può anche preparare il permanganato di sodio, che normalmente cristallizza idrato NaMnO4 · 3H2O, molto solubile in acqua; esso però è meno usato del sale potassico in quanto è meno attivo. Il KMnO4 e lo MnO2 sono i due composti del m. commerciati in maggior quantità. ║ Usi: il m. come metallo puro non trova impieghi strutturali, data la fragilità delle fasi stabili a temperatura ambiente. Viene quindi usato pressoché solo esclusivamente per fili speciali per l'industria elettrotecnica, ma si tratta di impieghi insignificanti rispetto a quelli metallurgici (fabbricazione di leghe) che assorbono circa il 90% del metallo prodotto. Il restante 10% viene impiegato sotto forma di composti, principalmente il biossido MnO2 (per pile a secco), il permanganato KmnO4 (come ossidante e disinfettante), il solfato (per lo stampaggio dei cotoni e come fertilizzante per terreni poveri di m.), il cloruro MnCl2 (per lo stampaggio del cotone e in metallurgia per addizionare Mn a certe leghe) e come naftenato e resinato (composti addizionati a vernici siccative per favorirne l'essiccamento). ║ Leghe: si considerano qui le leghe di m. a eccezione di ghise e acciai, trattati a parte. Le leghe di m. sono di due tipi: per impieghi speciali e leghe in cui esso compare come elemento di addizione. Nelle prime ricadono ad es. le leghe per resistenze elettriche, di solito a base di rame e m. (eventualmente con aggiunte di nichel) come la nota manganina (87% Cu e 13% Mn) e la sua variante (83% Cu, 13% Mn e 4% Ni); una lega ad altissima resistività è la 68% Cu, 5% Ni e 27% Mn. Si hanno poi varie leghe magnetiche. Fra le leghe in cui il m. appare come elemento di addizione, escludendo quelle ferrose, citiamo alcune fra le principali famiglie: 1) leghe di alluminio, che ne contengono dallo 0,2 allo 1,2%, come la lega 3003 (1,2% di Mn, resto Al); 2) leghe di rame, e in particolare bronzi al m., leghe ad altissima resistenza (fino a 80 kg/mm²) che ne contengono dallo 0,5 al 4%; 3) leghe di magnesio, che ne contengono dallo 0,1 allo 1,2%; 4) leghe di nichel, come il Nichel-D che ne contiene il 4,5%; 5) leghe di titanio, come quelle binarie al 4% e 8% di Mn (resto titanio). Fra le leghe speciali a basso tenore di ferro meritano poi di essere ricordate diverse leghe Monel (0,6÷1,7% Mn) e diverse leghe Inconel (0,2÷0,7% Mn). ║ Acciai e leghe ferrose: salvo casi particolarissimi, il m. è sempre presente in tutte le leghe ferrose, acciai compresi, in quanto esso si trova come impurezza nei minerali, quando addirittura non viene introdotto appositamente. La riduzione degli ossidi di m. è più difficile di quella degli ossidi di ferro, e avviene solo nella zona più calda dell'altoforno: il rendimento di questo in m. (calcolato come frazione del m. nei minerali di carica che passa nella ghisa) è di circa il 70%, il rimanente passando nella scoria in forma di silicato. Data la maggior affinità che il m. ha per l'ossigeno rispetto al ferro, esso esercita sulle leghe ferrose un'efficace azione disossidante. Nel processo di affinazione in convertitore Bessmer avviene addirittura la reazione di scambio:
Mn + FeO ◊ MnO + Fe
che, insieme con l'analoga del silicio, eleva la temperatura della massa nella prima fase di soffiaggio. La ghisa comunemente caricata nel Bessmer contiene lo 0,8÷1,5% di Mn; la maggior parte passa nella scoria come ossido o altri composti (essa finisce per contenere il 10÷40% di Mn) mentre nel prodotto affinato è sotto il 0,7%. Nel processo di affinazione al convertitore Thomas si carica una ghisa con lo 1÷1,5% di Mn; anche qui subisce la stessa fine perché si ossida subito all'inizio del soffiaggio. Anche nell'affinazione su suola il m. si ossida per cui il suo tenore si riduce fortemente fino a scendere allo 0,2÷0,6%, salvo che verso la fine non lo si aggiunga come correttivo. Gli acciai comuni al carbonio contengono relativamente poco m., dallo 0,3 allo 0,4% con punte massime fino allo 0,7%; in questo caso tale elemento è considerato quasi come una impurezza. Solo quando il suo tenore si aggira sull'1% o più si comincia a considerarlo un elemento di lega. Il m. è solubile nel ferro in tutti i rapporti anche allo stato solido, ma ne modifica la struttura. Così, per un ipotetico acciaio allo 0% di carbonio, si ha una struttura perlitica fino al 5÷6% di m., poi la struttura diventa martensitica e infine, sopra il 12-13,5% di Mn, diventa austenitica. Questi valori sono molto influenzati dal tenore di carbonio; ad es. con lo 0,5% di carbonio la struttura perlitica è stabile sotto il 4% circa di Mn e quella martensitica si ha fino al 9÷10% di Mn. Con lo 1% di carbonio la struttura austenitica si ottiene già con meno del 6% di m. Riportando in diagramma in ascissa il tenore di carbonio e in ordinata quello di m. (diagramma di Guillet) si ottiene una divisione netta in campi di stabilità delle diverse strutture. I tipi di acciai al m. più usati sono: a) acciai perlitici, con carbonio fra 0,3 e 1% e di m. fra lo 0,8 e il 2%; b) acciai austenitici allo 0,9÷1,2% di carbonio e 10÷14% di Mn. Questi ultimi in particolare sono preziosi perché: 1) hanno una elevata resistenza meccanica; 2) sono resistentissimi all'usura; 3) sono amagnetici; 4) sono assai tenaci; 5) possono essere induriti superficialmente per martellatura, pallinatura o altro sistema, mantenendo tutta la tenacità nel cuore e le loro caratteristiche di resistenza (carico di rottura a trazione fino a 110 kg/mm², di snervamento fino a 50 kg/mm², allungamento a rottura fino al 65%, durezza fino a 210 Brinell, resilienza fino a 30 kgm/cm²). Questi acciai resistono male alla corrosione a secco, a caldo e anche a umido in presenza di numerosi sali, ma non sono molto aggrediti dagli agenti atmosferici, data la loro struttura austenitica (propria degli acciai inossidabili, compreso il comune 18/8) per cui vengono talvolta enumerati fra gli inossidabili, costituendo la cosiddetta serie 200 della classificazione americana AISI. Ricordiamo in particolare i tipi AISI 201 (17% Cr, 4,5% Ni, 6,5% Mn, 0,15% max C, 0,25% max N2 e resto ferro) e AISI 202 (18% Cr, 8% Mn, 5% Ni, 0,15% max C, 0,25 % max N2 e resto ferro) che hanno un carico di snervamento convenzionale sui 40 kg/mm², un carico di rottura a trazione di 75÷80 kg/mm², un allungamento a rottura del 55÷60% e una durezza di 90 Rockwell-B. In generale, a parte le leghe nelle quali il m. è indispensabile, il suo dosaggio deve essere controllato, in quanto la sua aggiunta comporta per un acciaio sia vantaggi che svantaggi. Fra i vantaggi, ricordiamo: aumento della temprabilità, abbassamento della temperatura di tempra e ricottura, diminuzione delle deformazioni causate dalla tempra e aumento della penetrazione di questa, aumento della tenacità senza peggiorare la resistenza a trazione, aumento della resistenza a trazione a pari tenacità (10 kg mm² circa per ogni 1% di Mn) e miglioramento della lavorabilità a caldo. Tra gli svantaggi ricordiamo: abbassamento della conducibilità termica (e quindi maggior difficoltà nei trattamenti termici), diminuzione della lavorabilità plastica a freddo, diminuzione della saldabilità, peggioramento della sensibilità al surriscaldo, diminuzione della lavorabilità all'utensile, peggioramento delle qualità elettriche e magnetiche. Una importante azione svolta dal m. negli acciai è poi il sequestro dello zolfo residuo in forma di MnS; tale elemento formerebbe, altrimenti, un solfuro FeS che si disporrebbe al contorno dei grani; per riscaldamento del materiale si avrebbe un eutettico Fe-FeS bassofondente (1.000 °C circa) per cui il materiale si sgretolerebbe giungendo a 1.100÷1.200 °C, come talvolta fa nella lavorazione a caldo (fragilità al rosso). Gli acciai austenitrici al m. vengono impiegati soprattutto dove si richiede elevata resistenza all'usura e agli urti: casi tipici sono scambi ferroviari e tramviari, mascelle per frantoi e mulini, e così via. In certi casi sono anche utili per la loro amagneticità. Considerazioni più o meno simili a queste fatte per gli acciai si possono fare anche per le ghise. La ghisa grigia non legata contiene lo 0,8% circa di Mn che scende allo 0,5% circa per i tipi malleabili. La maggior parte delle ghise legate (come i tipi Ni-Hard e Ni-Resist e altri) contengono però tenori superiori di m., tipicamente dallo 0,6 all'1,25%. Infine il m. compare come elemento di alligazione in numerose leghe ferrose per impieghi speciali.