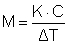Ebullioscopìa.
Chim. - Metodo per la determinazione del peso molecolare di sostanze che si basa sull'innalzamento del punto di ebollizione di una sostanza (solvente) quando in essa ne venga sciolta un'altra (soluto). Questo metodo è analogo a quello crioscopico (V. CRIOSCOPIA). è noto che se ad un liquido (solvente) viene aggiunto un solido che in esso si scioglie (soluto) tanto poco volatile che la sua tensione di vapore possa essere considerata nulla, la tensione di vapore della soluzione è inferiore a quella del solvente puro. Da un punto di vista termodinamico si può affermare che l'aggiunta del soluto abbassa il livello di potenziale chimico del solvente. Come risultato pratico si avrà che la soluzione bolle a temperatura più alta del solvente puro, in quanto la temperatura di ebollizione (a pressione atmosferica) non è altro che la temperatura per la quale un liquido raggiunge una tensione di vapore pari ad un'atmosfera (la tensione di vapore è sempre una funzione crescente della temperatura).
![]()
![]()
Detta P la tensione di vapore attuale della soluzione e P0 quella che avrebbe il solvente puro alla stessa temperatura, la legge di Raoult (enunciata nel 1877) stabilisce fra queste quantità la relazione:
P = x · P0
ove x è la frazione molare del solvente, che è sicuramente minore di uno in una soluzione. Se diciamo y la frazione molare del soluto, essendo x + y = 1 per definizione, si può scrivere che:
P = (1 - y) · P0
Per questo si ricava che la differenza di tensione di vapore P0 - P è data da:
P0- P = y · P0
cioè è proporzionale alla frazione molare del soluto. Manipolando questa relazione e tenendo conto delle leggi della termodinamica si giunge alla relazione:
nella quale: M = peso molecolare del soluto, C = concentrazione del soluto (grammi/1.000 grammi di solvente), T = spostamento del punto di ebollizione per l'aggiunta del soluto. La costante K dipende essenzialmente solo dal solvente, e rappresenta l'innalzamento del punto di ebollizione che si ha allorché si aggiunge una mole di soluto a 1.000 grammi di solvente; è detta costante ebullioscopica, e può essere ricavata conducendo una prova con un soluto a peso molecolare noto. Questa costante K può anche essere calcolata teoricamente a partire dalla temperatura di ebollizione (del solvente) e dal suo calore di evaporazione con la formula di Van't Hoff; i risultati sono in accordo con l'esperienza.
![]()
![]()
Le costanti ebullioscopiche dei solventi più comuni sono relativamente molto basse, inferiori di solito a quelle crioscopiche per gli stessi solventi; ad esempio K vale 0,52 per l'acqua, 5,2 per il bromo, 2,67 per il benzene, 3,07 per l'acido acetico, 3,66 per il cloroformio, 3,41 per l'anilina. Questo fatto e alcune difficoltà operative rendono il metodo ebullioscopico meno preciso e più laborioso di quello crioscopico che è quindi più usato. La determinazione dell'innalzamento ebullioscopico viene fatta mediante l'apparecchio ebullioscopico di Beckmann o quello di Landsberger; quest'ultimo è il più preciso. In entrambi i casi si usa il termometro differenziale a scala arbitraria di Beckmann. Una parte delicata della procedura è la condensazione dei vapori per impedire che la soluzione si vada concentrando. Il metodo poi, come quello crioscopico, cade in difetto se si hanno reazioni chimiche fra soluto e solvente, se si hanno fenomeni associativi fra gli stessi o anche fra molecole di soluto, e infine se questo si dissocia in soluzione. In questi casi le misure ebullioscopiche possono essere ugualmente fatte per sostanze a peso molecolare noto per determinarne uno apparente, e risalire da questo all'entità dell'associazione o della dissociazione. Si tratta comunque di un metodo indiretto e valido solo alle concentrazioni basse, in quanto le leggi date per l'e. non valgono per soluzioni fortemente concentrate, quali sono quelle di maggior interesse pratico.
![]()
Guadagnare navigando! Acquisti prodotti e servizi.
Guadagnare acquistando online.
![]()
![]()
![]()
Enciclopedia termini lemmi con iniziale a b c d e f g h i j k l m n o p q r s t u v w x y z
Storia Antica dizionario lemmi a b c d e f g h i j k l m n o p q r s t u v w x y z
Dizionario di Storia Moderna e Contemporanea a b c d e f g h i j k l m n o p q r s t u v w y z
Lemmi Storia Antica Lemmi Storia Moderna e Contemporanea
Dizionario Egizio Dizionario di storia antica e medievale Prima Seconda Terza Parte
Storia Antica e Medievale Storia Moderna e Contemporanea
Dizionario di matematica iniziale: a b c d e f g i k l m n o p q r s t u v z
Dizionario faunistico df1 df2 df3 df4 df5 df6 df7 df8 df9
Dizionario di botanica a b c d e f g h i l m n o p q r s t u v z
![]()